Forschende des BNITM auf dem Weg zu einem Hautorganmodell mit Immunzellen
Neue Einblicke in die Interaktionen zwischen Hautzellen, Erreger und dem Immunsystem
Stechmücken, Wanzen und Zecken stechen und beißen den Menschen in die Haut. Dabei können diese sogenannten Vektoren den Menschen mit Erregern infizieren. Die Folge sind Erkrankungen wie Malaria, Denguefieber und die Chagas-Krankheit. Über die Eintrittspforte Haut ist immunologisch nicht viel bekannt. Forschende des Bernhard-Nocht-Instituts für Tropenmedizin (BNITM) untersuchten in einem humanen Zellkulturmodell, wie der Erreger der Chagas-Krankheit Trypanosoma cruzi in Hautzellen eintritt und wie bestimmte Immunzellen darauf reagieren. Zukünftig möchten sie für ihre Experimente ein Hautorganmodell mit Immunzellen nutzen. Wichtige Vorarbeiten für dieses Forschungsvorhaben publizierten die Forschenden kürzlich in der Fachzeitschrift PLOS Neglected Tropical Diseases.
Dr. Thomas Jacobs, Leiter der Forschungsgruppe Protozoen-Immunologie am BNITM, und Dr. Rosa Isela Gálvez wählten für die Vorarbeiten die Infektion von humanen Keratinozyten, Hautzellen der Oberhaut, mit dem Parasiten Trypanosoma cruzi (= T. cruzi) aus. Raubwanzen übertragen den einzelligen Parasiten in die Haut von Menschen und anderen Säugetieren. In Wirtszellen wie den Keratinozyten vermehrt sich T. cruzi. Über den Blutkreislauf gelangt der Parasit in weitere Zellen und Gewebe wie in die Muskulatur des Wirtsorganismus. Beim Menschen löst T. cruzi die Chagas-Krankheit aus. Akut tritt unter anderem eine lokale Schwellung an der Eintrittsstelle in der Haut auf. Wenn sich die Erkrankung chronifiziert, vergrößern sich Organe wie das Herz, und Nervenzellen des Magen-Darm-Traktes werden zerstört. Daher verläuft die Erkrankung zumeist tödlich. Die Chagas-Krankheit gehört zu den vernachlässigten Tropenkrankheiten (neglected tropical diseases = NTDs) und kommt vor allem in Lateinamerika vor.
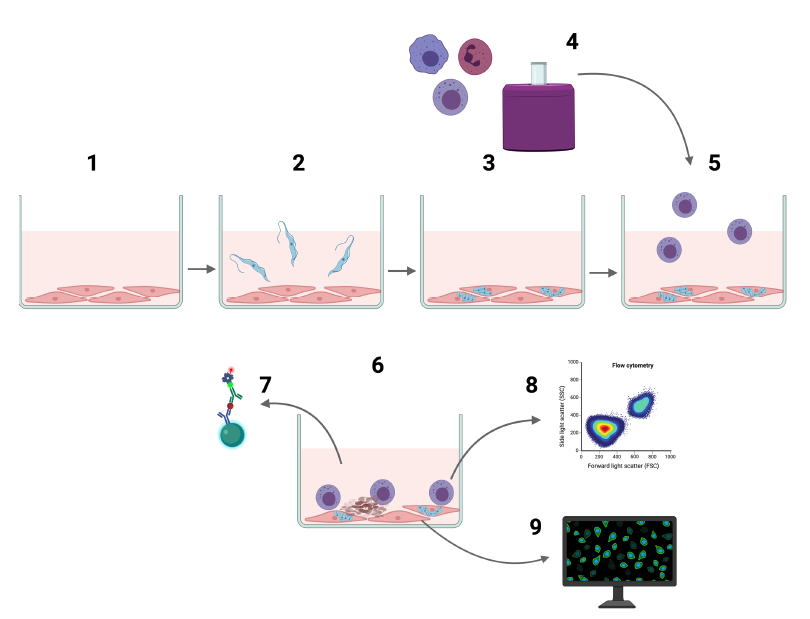
Die Forschenden verwendeten ein neuartiges Ko-Kulturmodell, um die Wechselwirkungen zwischen mit T. cruzi-infizierten Keratinozyten und natürlichen Killerzellen (NK-Zellen) zu untersuchen. NK-Zellen sind eine Art von Immunzellen, die mit Erregern infizierte Zellen abtöten können. Sie wählten die NK-Zellen aus, da diese essenziell bei der Bekämpfung von T. cruzi sind. Die Keratinozyten gewannen die Wissenschaftler:innen aus Biopsien von gesunden Proband:innen. Von denselben Personen isolierten sie natürliche Killerzellen aus Blutproben.
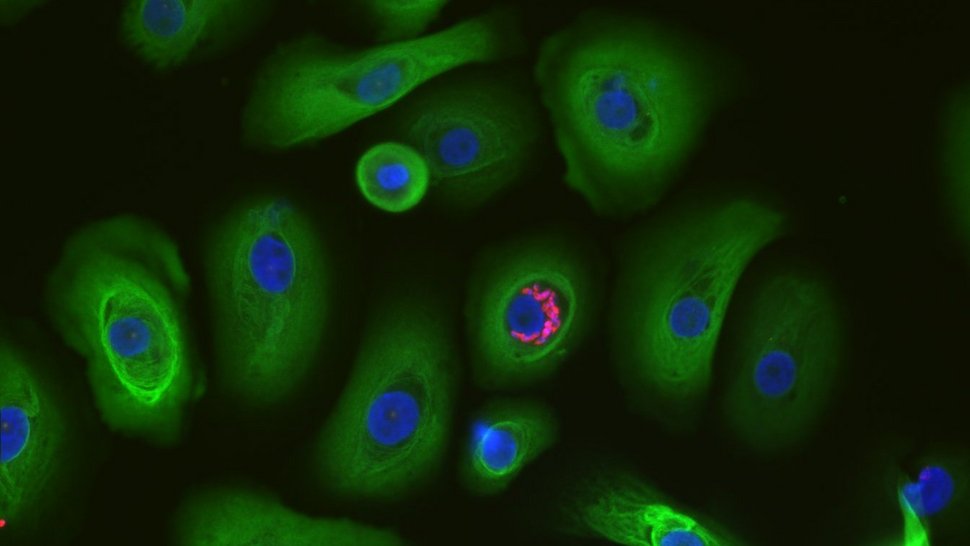
T. cruzi infiziert Keratinozyten im Zellkulturmodell
„In einem ersten wichtigen Schritt konnten wir zeigen, dass der Parasit T. cruzi Keratinozyten in einem Zellkulturmodell infizieren kann. Wenn wir später mit Hautorganmodellen arbeiten, muss sichergestellt sein, dass die Infektion erfolgreich ist. Sonst würden wir teure Ressourcen verschwenden“, ordnet die Immunologin Gálvez ein.
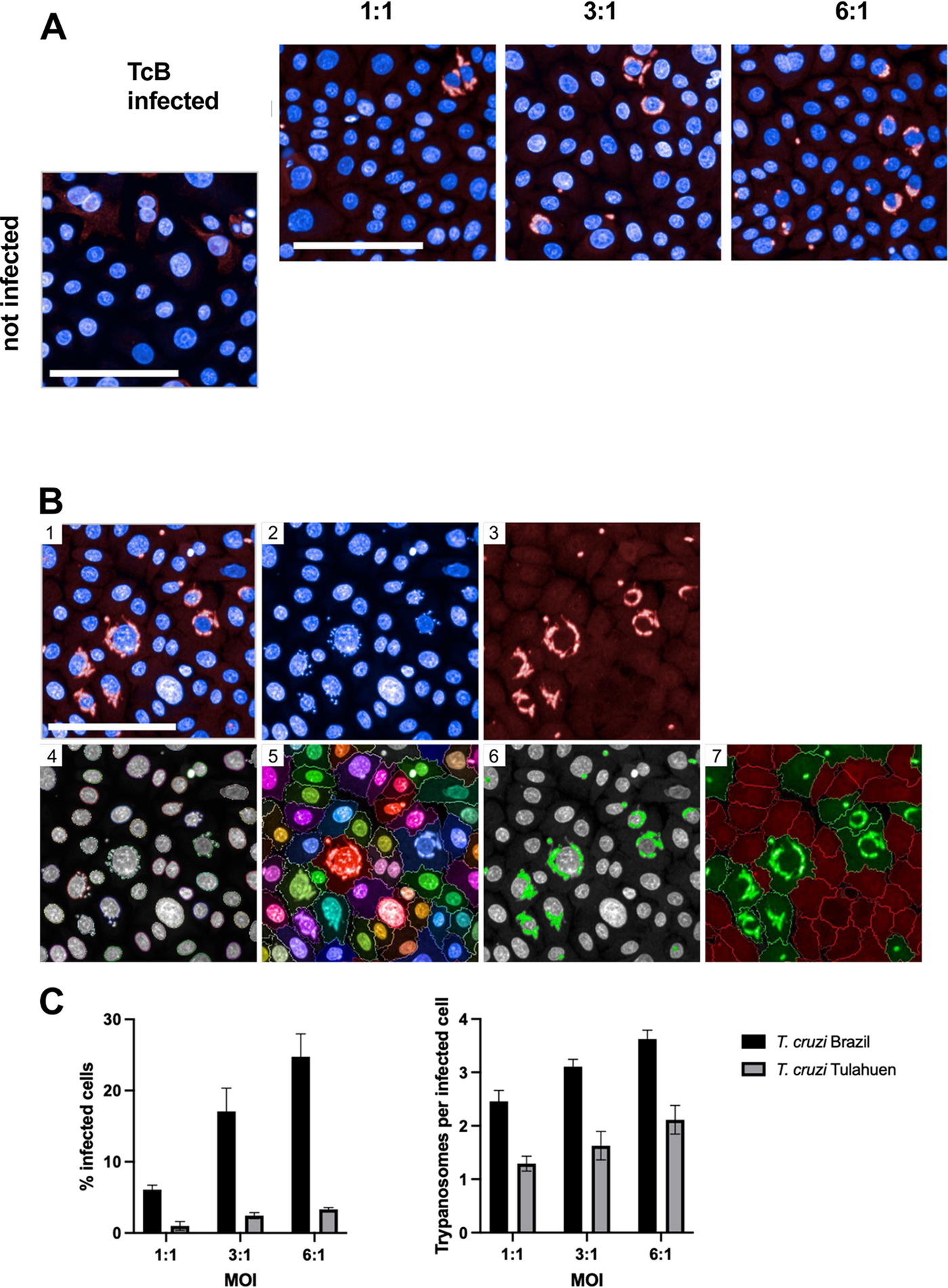
Natürliche Killerzellen erkennen mit T. cruzi-infizierte Keratinozyten
Nach der erfolgreichen Infektion der Keratinozyten mit T. cruzi fügten die Forschenden die NK-Zellen hinzu. Die infizierten Keratinozyten aktivierten die NK-Zellen stark.
Gálvez erläutert: „Unsere Untersuchungen zeigen, dass Keratinozyten nicht nur als Reservoir für den Parasiten dienen, sondern auch eine aktive Rolle bei der Immunantwort spielen. Die Interaktion zwischen infizierten Keratinozyten und NK-Zellen aktiviert NK-Zellen stark. Diese setzen daraufhin wichtige proentzündliche Moleküle wie Interferon-gamma und weitere zytotoxische Moleküle frei, um die Infektion zu bekämpfen.“
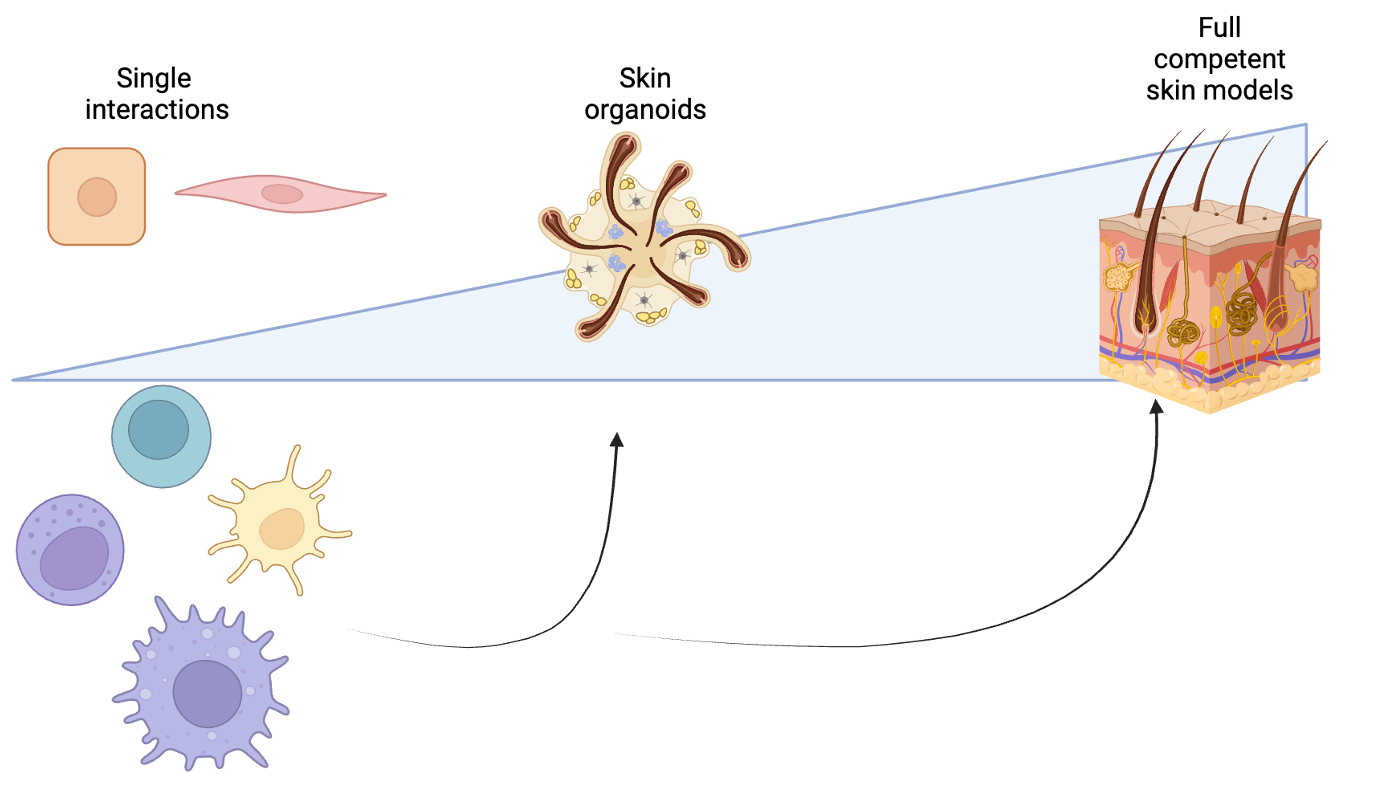
Ziel: Immunkompetentes Hautorganmodell
Hautorganmodelle, die die unterschiedlichen Hautzelltypen enthalten, existieren schon. Jedoch fehlen in diesen Modellen noch die Immunzellen. Die neuen Erkenntnisse des Forschungsteams um Gálvez und Jacobs unterstreichen, wie bedeutend die Haut als immunologisches Organ ist. Sie zeigen auf, wie wichtig es ist, ein Modell, das neben Haut- auch Immunzellen besitzt (also ein immunkompetentes Hautorganmodell), zu entwickeln. Das Mausmodell könnten die Forschenden hier nicht verwenden, da sich die Zusammensetzung der Immunzellen in der Haut von Maus und Mensch sehr stark voneinander unterscheiden.
„Bisher ist das Ko-Kulturmodell das einzige Modell, das für unsere Untersuchungen verfügbar ist. Damit haben wir nun einige Wechselwirkungen zwischen Wirtszellen, Erregern und den natürlichen Killerzellen näher beleuchtet. Eine detaillierte Charakterisierung der Immunantwort in der Haut kann dazu beitragen, effektivere Therapiestrategien gegen Tryponosoma cruzi zu entwickeln, aber auch gegen andere Erreger, die über die Haut in den Menschen eindringen. Für diese Charakterisierung ist es unumgänglich, ein immunkompetentes Hautorganmodell zu etablieren“, schließt Jacobs.
Originalpublikation
Institutionen der Kooperationspartner:innen
Ansprechperson
Dr. Rosa Isela Gálvez
Wissenschaftliche Mitarbeiterin (Postdoc)
Telefon : +49 40 285380-857
E-Mail : rosa.galvez@bnitm.de
PD Dr. Thomas Jacobs
Research Group Leader
Telefon : +49 40 285380-850
Fax : +49 40 285380-400
E-Mail : tjacobs@bnitm.de
Dr. Anna Hein
Presse- & Öffentlichkeitsarbeit
Telefon : +49 40 285380-269
E-Mail : presse@bnitm.de






