Infektiöse Meisterdiebe oder wie Malaria-Parasiten unseren roten Blutfarbstoff stehlen und verdauen
Es ist ein raffinierter molekularer Mechanismus, mit dem Malaria-Parasiten den Inhalt ihrer Wirtszellen in die eigene Zelle aufnehmen und abbauen, um ihr Überleben zu sichern. Ein Forschungsteam des BNITM liefert neue Einblicke, welche Proteine daran beteiligt sind und wie diese zusammenarbeiten. Die Forschenden haben ihre Ergebnisse im Wissenschaftsjournal PLOS Biology veröffentlicht.
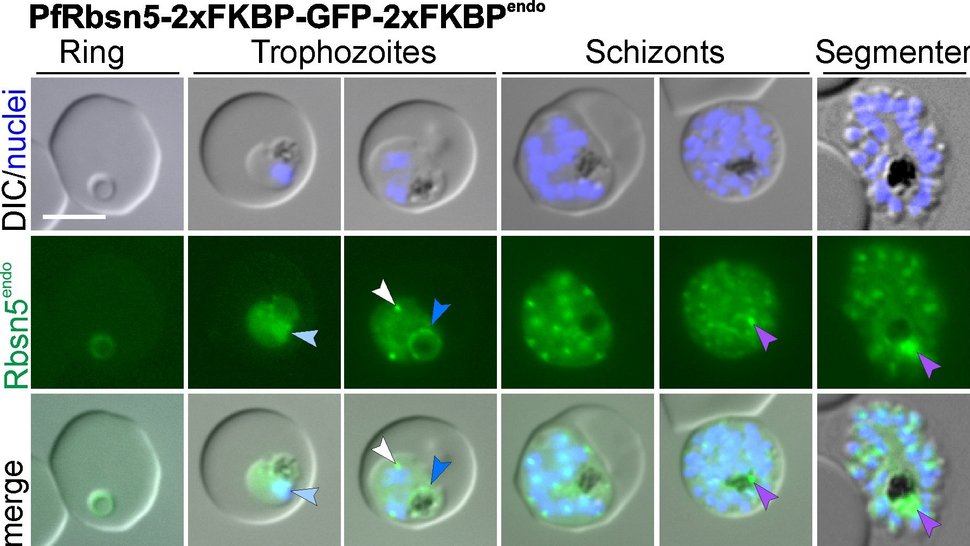
Malaria-Parasiten kapern menschliche rote Blutzellen, entwickeln sich darin weiter und wachsen. Um Platz und Nahrung zu gewinnen, „fressen“ sie fast vollständig den Inhalt ihrer Wirtszelle und verdauen ihn in ihrer Nahrungsvakuole. Dabei handelt es sich überwiegend um das Eiweiß Hämoglobin. Wie laufen Aufnahme und Transport von Hämoglobin auf molekularer Ebene ab, welche Proteine sind beteiligt, und wo finden sich Ansatzpunkte, die Parasiten dabei zu stören? Mit diesen Fragen beschäftigt sich die Forschungsgruppe „Malaria Zellbiologie“ unter der Leitung von Dr. Tobias Spielmann.
Dabei hat sie nun zwei Proteine identifiziert, Rabenosyn-5 und Rab5b, die offenbar für diesen Prozess essenziell sind. Während einer Studie inaktivierten sie diese Proteine in Plasmodium falciparum-Parasiten und stellten fest: In ihren Mutanten sammelten sich mit Hämoglobin gefüllte Bläschen, und kein neues Hämoglobin erreichte die Verdauungsvakuole. Die Parasiten konnten nicht weiterwachsen und starben. Rabenosyn-5 und Rab5b erwiesen sich als Schlüsselproteine im Transport von Hämoglobin zur Verdauungsvakuole des Malaria-Parasiten.
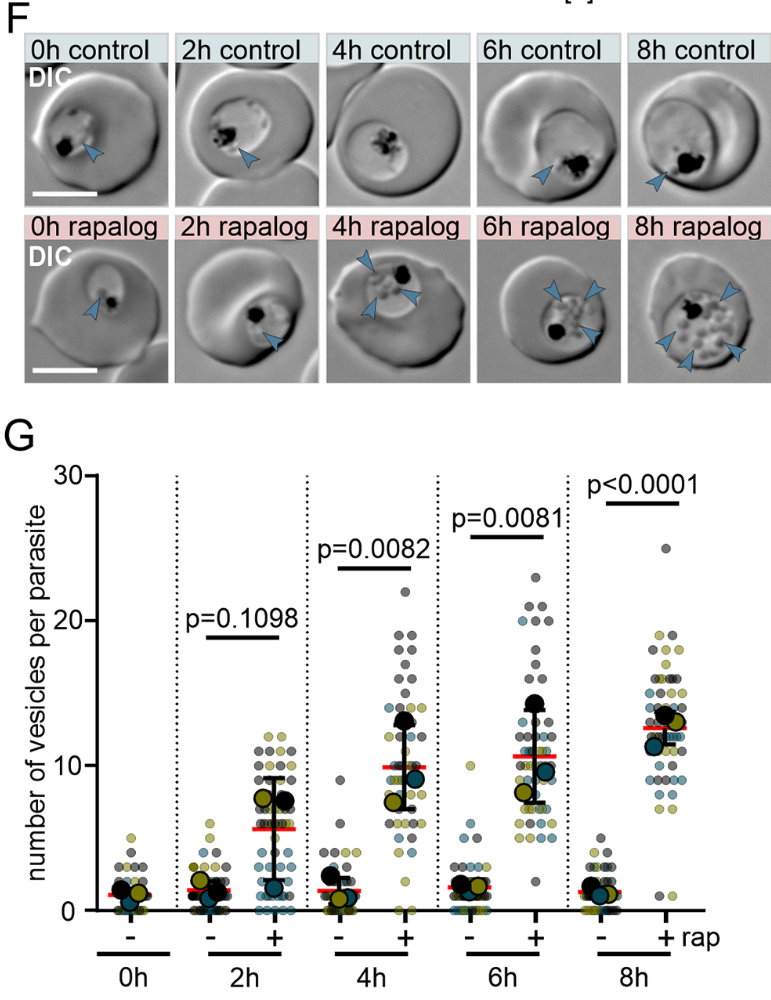
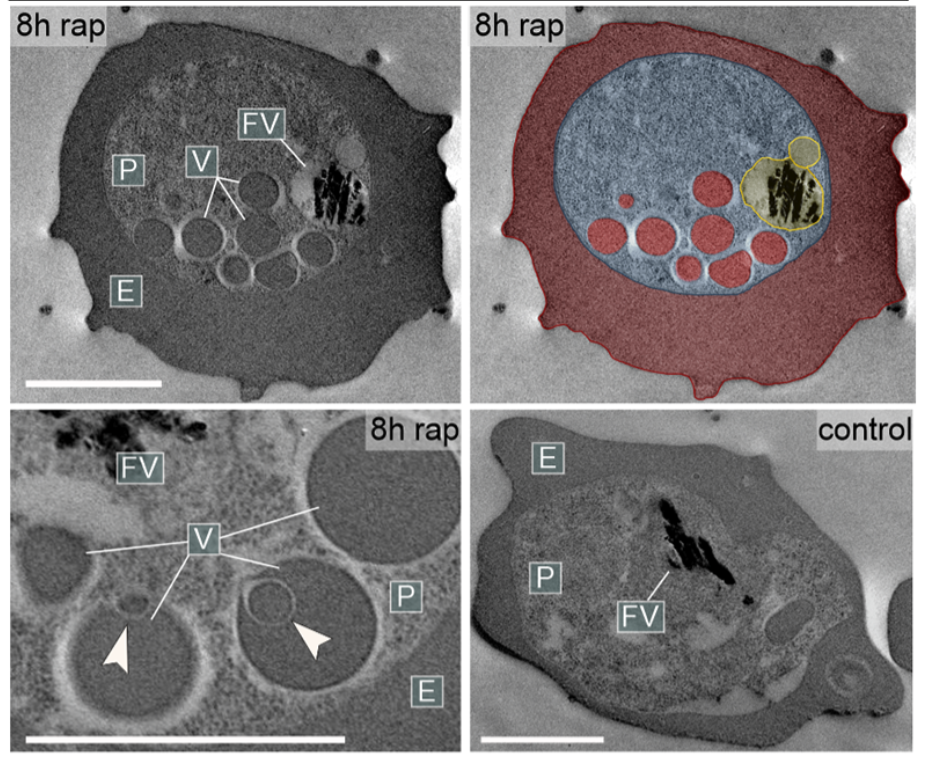
Außerdem konnte das Team um Erstautorin Ricarda Sabitzki nachweisen, dass diese beiden Proteine mit einem anderen Protein, VPS45, zusammenarbeiten: Gemeinsam vermitteln sie den Transport von Nährstoffen aus der Wirtszelle in die Verdauungsvakuole des Parasiten.
Überraschenderweise zeigt dies, dass der Erreger ähnliche Proteine zum Transport von aufgenommenem Material verwendet wie andere Organsimen, wie der Mensch zum Beispiel. Erst kürzlich hatte die Forschungsgruppe nämlich in anderen Studien nachgewiesen, dass der eigentliche Schritt, um Hämoglobin von der Wirtszelle überhaupt in die Zelle aufzunehmen, im Vergleich zu anderen Organismen sehr ungewöhnlich ist (PMID: 38039338; PMID: 31896710); dass es sich hierbei also um einen sehr Parasiten-spezifischen Aufnahmeprozess handelt.
Im Gegensatz dazu konnte das Team jetzt zeigen: Dieser Aufnahmeprozess führt in einen Transportweg, der Elemente enthält, die für alle Organismen typisch sind. Man kann annehmen, dass Medikamentenentwicklung gegen den ersten Teil vielversprechender ist, da eine spezifische Hemmung von Parasitenprozessen leichter möglich ist.
„Wir haben zwei entscheidende molekulare Akteure enttarnt, die den Malaria-Parasiten bei beim Transport des aus der Wirtszelle entwendeten Hämoglobins in die Verdauungsvakuole unterstützen“, sagt Dr. Tobias Spielmann, Forschungsgruppenleiter und Letztautor der Studie. „Und wir haben insgesamt Einblicke in die fundamentale Biologie von Plasmodium falciparum-Parasiten im Blutstadium gewonnen. Das kann helfen, neue Ansatzpunkte für die Medikamenten-Entwicklung gegen Malaria zu finden.“
Die Entwicklung neuer Therapien gegen Malaria ist dringend erforderlich. Der derzeit wichtigste verfügbare Wirkstoff Artemisinin verliert zunehmend an Wirksamkeit, weil die Parasiten Resistenzen entwickeln.

Hintergrund
Malaria ist nach wie vor eine der tödlichsten Infektionskrankheiten. Allein im Jahr 2022 starben weltweit mehr als 600.000 Menschen, schätzt die Weltgesundheitsorganisation (WHO). Etwa 450.000 davon waren Kleinkinder unter fünf Jahren. Am stärksten betroffen sind Länder südlich der Sahara.
Die Studie ist in dem Wissenschafts-Journal PLOS Biology erschienen. Sie wurde finanziert durch den Europäischen Forschungsrat (ERC Advanced Grant) und die Deutsche Forschungsgemeinschaft (DFG-Graduiertenkolleg 2771). Weitere Förderer: Jürgen Manchot Stiftung und European Molecular Biology Organization (EMBO).
Originalpublikation: Sabitzki, R. et al.: Role of Rabenosyn-5 and Rab5b in host cell cytosol uptake reveals conservation of endosomal transport in malaria parasites. PLOS Biology May 31, 2024. DOI: 10.1371/journal.pbio.3002639
In Verbindung stehende Artikel
Artemisinin-Resistenz bei Malariaparasiten entschlüsselt: Veröffentlichung in der Fachzeitschrift Science
Europäischer Forschungsrat fördert Spitzenforschung zur Antibiotikaresistenz von Malariaparasiten: Tobias Spielmann erhält ERC Advanced Grant.
Ansprechperson
Dr. Tobias Spielmann
Research group leader
Telefon : +49 40 285380-486
E-Mail : spielmann@bnitm.de
Julia Rauner
Presse- & Öffentlichkeitsarbeit
Telefon : +49 40 285380-264
E-Mail : presse@bnitm.de
Weiterführende Informationen







