Auf frischer Tat ertappt
Forschende beobachten, wie ein Phenuivirus mRNA-Kappen vom Wirt stiehlt
Viren nutzen für ihre Vermehrung die molekulare Infrastruktur der infizierten Wirtszelle. Während die virale Polymerase die genetische Information des Virus vervielfältigt, wird das Ribosom des Wirts für die Produktion der viralen Proteine benötigt. Der Prozess, mit dem ein Ribosom RNA in ein Protein umwandelt - die sogenannte Translation - ist streng kontrolliert und benötigt eine sogenannte 5'-RNA-Kappe. Phenuiviren können diese RNA-Kappen nicht selbst herstellen, sondern stehlen sie von ihrem Wirt. Doch wie? Forschende des Bernhard-Nocht-Instituts für Tropenmedizin (BNITM) und Kooperationspartner:innen haben mit Hilfe der Kryo-Elektronenmikroskopie verschiedene Phasen dieses Prozesses auf molekularer Ebene untersucht und sichtbar gemacht. Die Ergebnisse hat die Fachzeitschrift Nucleic Acids Research veröffentlicht.
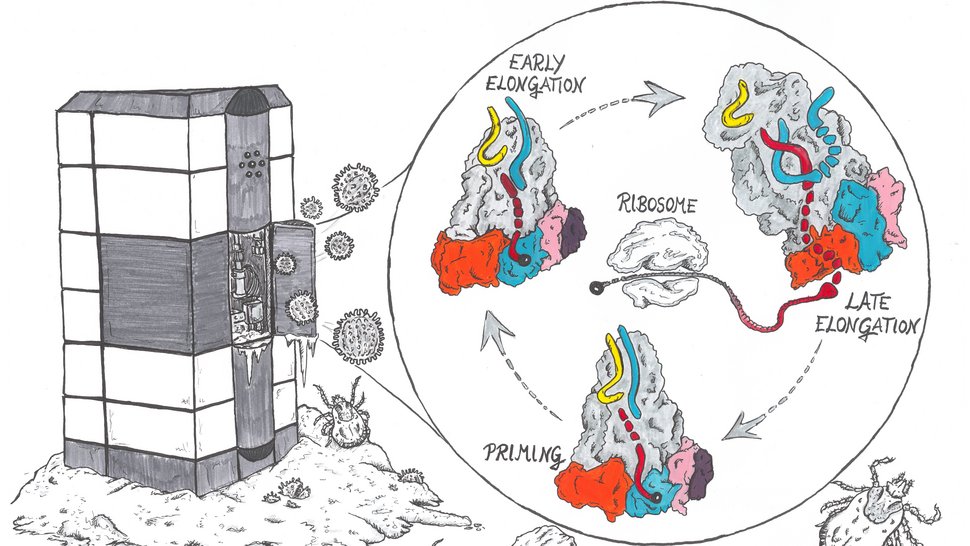
Das Schwere-Fieber-mit-Thrombozytopenie-Syndrom-Virus (SFTS-Virus) ist ein Phenuivirus, das zur Gruppe der Bunyaviren gehört. Es löst im Menschen eine Erkrankung aus, die u. a. Fieber, Muskelschmerzen, Durchfall und einen Abfall an Blutplättchen (Thrombozyten) umfasst. Schwere Infektionen können zu inneren Blutungen und Multiorganversagen führen. Zecken übertragen das SFTS-Virus und können neben dem Menschen eine Reihe von Haus- und Nutztieren wie Katzen und Kühe mit dem Virus infizieren. Zurzeit gibt es keine wirksamen Medikamente, die für den Einsatz gegen das SFTS-Virus zugelassen sind.
Kapern der Proteinfabrik des Wirts
„Bunyaviren benötigen eine Art kleinen Schlüssel, um Zugang zur Maschinerie der Wirtszellen zu bekommen“, erklärt Dr. Maria Rosenthal, Leiterin der BMBF-Nachwuchsgruppe Strukturelle Virologie am BNITM. „Diese Schlüssel sind die RNA-Kappen des Wirts. Mit diesem Schlüssel kapern die Viren das Ribosom, also die Proteinfabrik des Wirts.“

In der Wirtszelle läuft die Bildung von Proteinen so ab: Das Ribosom erkennt die RNA-Kappe einer Boten-RNA (messenger RNA = mRNA) und beginnt, Proteine zu bilden. Befindet sich keine RNA-Kappe an einem RNA-Strang, findet normalerweise keine Proteinbildung statt. An der RNA der Bunyaviren ist keine Kappe vorhanden. Diese Viren benötigen deshalb eine Strategie, die Kappen – also den Schlüssel – zu ergattern. Einige Viren, darunter das SFTS-Virus, stehlen der Wirtszelle die RNA-Kappen, indem sie die Kappen von der Wirts-RNA abschneiden. Wie erwartet ist das L-Protein des SFTS-Virus an diesem Prozess beteiligt. Aber wie der Prozess im Einzelnen abläuft, war noch nicht bekannt. In dieser Studie wählten die Forschenden die Methode Kryo-Elektronenmikroskopie (Kryo-EM), um mehr Einblick in diesen Prozess zu bekommen.

Strukturaufklärung mittels Kryo-Elektronenmikroskopie
Erstautor Dr. Harry M. Williams und seine Kolleg:innen von der Kryo-EM-Einrichtung am Centre for Structural Systems Biology (CSSB) nahmen unter der Leitung von Prof. Dr. Kay Grünewald mit der Kryo-EM eine Reihe von Fotos vom L-Protein auf. Ein einzelnes Bild reicht aus mehreren Gründen nicht aus, um die dreidimensionale Struktur des SFTS-Virus-L-Proteins aufzulösen. Proteine sind dreidimensionale Objekte – würden die Forschenden das L-Protein nur aus einer Richtung betrachten, könnten sie nur ein teilweises Verständnis für die Gesamtstruktur gewinnen.
„Eine weitere Einschränkung besteht darin, dass der Kontrast von Bildern, die wir mit Kryo-EM-Experimenten aufnehmen, in der Regel sehr schlecht ist. Um den Kontrast zu erhöhen, nehmen wir viele Bilder der L-Proteine während eines einzigen Experiments auf, überlagern diese Bilder und ziehen das Hintergrundsignal ab. Wir müssen aber aufpassen und nur diejenigen Fotos zusammenrechnen, die das L-Protein in ähnlicher Form zeigen. Das L-Protein ist groß und hat flexible Domänen, die in verschiedene Richtungen zeigen können. Wir verbringen oft viel Zeit damit herauszufinden, welche Bilder wir kombinieren können“, beschreibt Williams den Prozess.
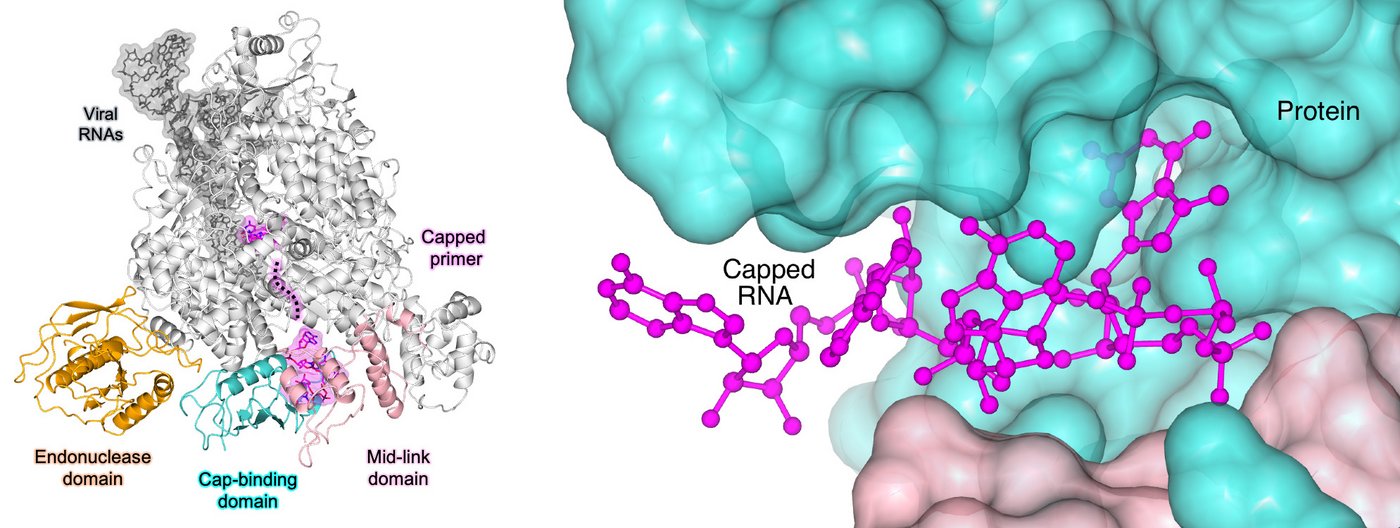
Virales L-Protein stiehlt die RNA-Kappe des Wirts
Das Forscherteam konnte mit den strukturellen Erkenntnissen aus der Kryo-EM und zusätzlichen Experimenten zeigen, wie das virale L-Protein des SFTS-Virus an RNA-Kappen des Wirtes bindet und diese von dem restlichen RNA-Strang abspalten kann. Auch klärten sie auf, dass das Virus die RNA-Kappen als Startpunkt für die Neubildung eines viralen mRNA-Stranges nutzt. "Wir glauben zwar, dass noch andere Moleküle der Wirtszelle bei der Übergabe von Wirts-mRNA an die viralen L-Proteine eine Rolle spielen, aber der Prozess des Stehlens der Kappen selbst wird vollständig vom L-Protein gesteuert. Das L-Protein allein reicht aus, um die Wirts-RNA zu erkennen, die Kappe davon abzuschneiden und neue virale mRNA herzustellen", sagt Williams. Im nächsten Schritt, den die Forschenden in dieser Studie noch nicht unter die Lupe genommen haben, erkennt das Ribosom der Wirtszelle die RNA-Kappe an dem neu gebildeten viralen RNA-Strang und bildet virale Proteine.
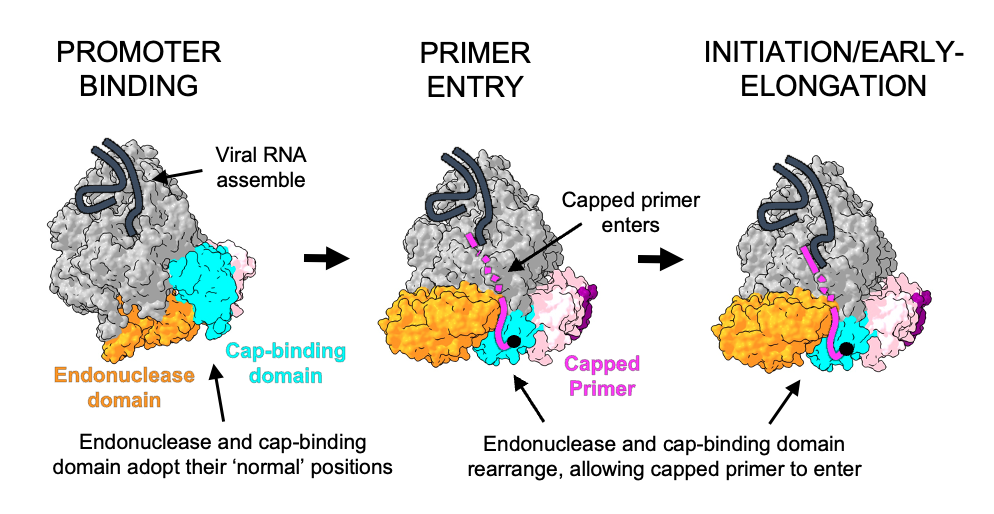
Stehlen der RNA-Kappen als Angriffspunkt für neue Medikamente
Essentielle Schritte im Lebenszyklus von Viren können Ansatzpunkte für die Entwicklung von hemmenden Medikamenten sein. Forschende identifizieren mit Methoden der Strukturaufklärung wie der Kryo-EM Stellen im Virus, an denen Medikamente wirken können. „Wenn wir den Prozess der viralen Transkription, also der Neubildung eines viralen mRNA-Stranges für die Proteinsynthese, inhibieren könnten, wäre der Lebenszyklus des Virus unterbrochen“, ordnet die Gruppenleiterin Rosenthal ein. In schon laufenden und künftigen Studien versuchen die Forschenden um Rosenthal, antivirale Wirkstoffe zu finden, die auf virusspezifische Prozesse abzielen, die das L-Protein durchführt und den beschriebenen Mechanismus des Stehlens der RNA-Kappen einschließen.
Originalpublikation
Institutionen der Kooperationspartner:innen
- Centre for Structural Systems Biology (CSSB), Hamburg, Germany
- Leibniz Institute of Virology, Hamburg, Germany
- University of Hamburg, Hamburg, Germany
- European Molecular Biology Laboratory, Grenoble, France
- Department of Virology, Institute for Integrative Biology of the Cell (I2BC), Centre National de la Recherche Scientifique (CNRS) UMR9198,Gif-sur-Yvette, France
- Fraunhofer Institute for Translational Medicine and Pharmacology (ITMP), Discovery Research ScreeningPort, Hamburg, Germany
Finanzierung
Ansprechperson
Dr. Maria Rosenthal
Gruppenleiterin
Telefon : +49 40 285380-930
E-Mail : rosenthal@bnitm.de
Ph.D. Harry Williams
Telefon : +49 40 285380-930
E-Mail : harry.williams@bnitm.de
Dr. Anna Hein
Presse- & Öffentlichkeitsarbeit
Telefon : +49 40 285380-269
E-Mail : presse@bnitm.de
Weiterführende Informationen







